 |
國家獸藥產(chǎn)業(yè)技術(shù)創(chuàng)新聯(lián)盟 National veterinary drug industry technology innovation alliance |
用戶登錄
聯(lián)系我們
|
 |
國家獸藥產(chǎn)業(yè)技術(shù)創(chuàng)新聯(lián)盟 National veterinary drug industry technology innovation alliance |
用戶登錄
聯(lián)系我們
|
獸藥產(chǎn)品批準(zhǔn)文號是農(nóng)業(yè)農(nóng)村部根據(jù)獸藥國家標(biāo)準(zhǔn),、生產(chǎn)工藝和生產(chǎn)條件批準(zhǔn)特定獸藥生產(chǎn)企業(yè)生產(chǎn)特定獸藥產(chǎn)品時核發(fā)的獸藥批準(zhǔn)證明文件,。在獸藥產(chǎn)品批準(zhǔn)文號審批依據(jù)[1]中,法規(guī)和規(guī)章類9項,、技術(shù)標(biāo)準(zhǔn)類16項,。其中,,《獸藥管理條例》為文號管理的最高上位法,《獸藥產(chǎn)品批準(zhǔn)參考文號管理辦法》為文號審批工作規(guī)章,,其余相關(guān)管理規(guī)章及技術(shù)標(biāo)準(zhǔn)均為文號審批管理支持性規(guī)定文件,。本文對近幾年文號管理相關(guān)制度和技術(shù)標(biāo)準(zhǔn)的新要求和審查中常見問題進(jìn)行了解析,為獸藥生產(chǎn)企業(yè)申請獸藥產(chǎn)品批準(zhǔn)文號提供參考,。
1.1獸藥產(chǎn)品比對試驗?zāi)夸浿乒芾?/span>
為解決部分原研藥品供應(yīng)短缺,、價格昂貴及壟斷市場等問題,降低畜牧養(yǎng)殖業(yè)防疫與治療成本,,農(nóng)業(yè)農(nóng)村部以養(yǎng)殖需求為導(dǎo)向,,按照科學(xué)合理、分類實施,、逐步推進(jìn)的思路,,鼓勵、指導(dǎo)與原研藥品等效的仿制獸藥生產(chǎn),,對進(jìn)口獸藥和部分新獸藥實施比對,,制定了獸藥比對試驗?zāi)夸洝+F藥比對試驗?zāi)夸洰a(chǎn)品的管理方式,,除可降低原研獸藥的價格,,打破原研獸藥市場壟斷外,還可進(jìn)一步促進(jìn)獸藥生產(chǎn)企業(yè)研究新的生產(chǎn)方法,,提高制藥工程技術(shù)水平,,優(yōu)化產(chǎn)業(yè)結(jié)構(gòu),,加速獸藥生產(chǎn)企業(yè)變革。獸藥比對試驗?zāi)夸浻赊r(nóng)業(yè)農(nóng)村部獸藥評審中心擬定,,農(nóng)業(yè)農(nóng)村部公布,,目前已公布5批共計422個產(chǎn)品。值得注意的是,,目錄中備注“無合法原料”和“本品為仿制品”的產(chǎn)品,,目前無法進(jìn)行文號申請。同時,,為確保獸藥產(chǎn)品安全,、有效和質(zhì)量可控,2016年12月,,農(nóng)業(yè)部辦公廳發(fā)布《獸藥比對試驗產(chǎn)品藥學(xué)研究等資料要求》,。
1.2《中華人民共和國獸藥典》(2020年版)頒布實施
2021年7月1日,《中國獸藥典》(2020年版)正式實施,,加強(qiáng)了安全性,、有效性研究,提高了產(chǎn)品質(zhì)量標(biāo)準(zhǔn),,持續(xù)完善了附錄體系,。新收載了部分已過監(jiān)測期獸藥注冊標(biāo)準(zhǔn),這些標(biāo)準(zhǔn)中一些產(chǎn)品已列入比對試驗?zāi)夸?,申請文號時仍執(zhí)行比對試驗?zāi)夸浿乒芾?。修訂品種中包括部分質(zhì)量標(biāo)準(zhǔn)通用名的規(guī)范性修訂,如卡巴匹林鈣可溶性粉改為卡巴匹林鈣粉,。中藥部分,,對將原中藥提取物類部分質(zhì)量標(biāo)準(zhǔn)修訂為成方制劑類,此類產(chǎn)品的批準(zhǔn)文號前綴將由“獸藥原字”變更為“獸藥字”,,而批準(zhǔn)文號的后四位品種編碼不發(fā)生變化,。
1.3產(chǎn)品復(fù)核檢驗指導(dǎo)原則的修訂
2022年3月,農(nóng)業(yè)農(nóng)村部按照“突出重點,,把控關(guān)鍵”的原則修訂了《獸藥產(chǎn)品批準(zhǔn)文號復(fù)核檢驗工作指導(dǎo)原則》,。主要變化集中在一是擴(kuò)大了首次申請文號產(chǎn)品檢驗的范圍,由檢驗1批產(chǎn)品全項目檢驗變?yōu)闄z驗3批樣品,,檢驗項目覆蓋質(zhì)量標(biāo)準(zhǔn)中所有檢驗項目,。二是對遷址重建等取得過文號的產(chǎn)品申請文號的,不再全項目檢驗,,而是按照不同劑型產(chǎn)品的必檢項目和關(guān)鍵項目進(jìn)行檢驗,。三是按照獸用生物制品類型制定必檢項目和關(guān)鍵項目。四是加強(qiáng)對文號有效期內(nèi)存在監(jiān)督抽檢不合格情形產(chǎn)品的檢驗,。這類產(chǎn)品在換發(fā)文號時,,需進(jìn)行3批產(chǎn)品的檢驗,檢驗項目覆蓋質(zhì)量標(biāo)準(zhǔn)中所有檢驗項目,。
1.4《獸藥GMP(2020修訂)》的實施
2020年6月1日起,,《獸藥生產(chǎn)質(zhì)量管理規(guī)范(2020年修訂)》開始正式施行。此版獸藥GMP修訂以我國獸藥行業(yè)特點和實際管理需求為基礎(chǔ),,吸收了歐盟和我國藥品GMP有關(guān)技術(shù)標(biāo)準(zhǔn),,更新了潔凈區(qū)動態(tài)級別規(guī)定,將獸藥生產(chǎn)潔凈室(區(qū))的空氣潔凈度的分級標(biāo)準(zhǔn)與WHO和歐盟GMP保持一致,提高了獸藥生產(chǎn)廠房設(shè)施的建設(shè)標(biāo)準(zhǔn)和要求,。獸藥產(chǎn)品批準(zhǔn)文號申請人提交生產(chǎn)工藝資料時,,對生產(chǎn)潔凈室(區(qū))的設(shè)置及描述應(yīng)符合《獸藥生產(chǎn)質(zhì)量管理規(guī)范(2020年修訂)》要求。
《獸藥生產(chǎn)質(zhì)量管理規(guī)范(2020年修訂)》非無菌獸藥附錄第四條要求,,質(zhì)量標(biāo)準(zhǔn)有微生物限度檢查等要求或?qū)ιa(chǎn)環(huán)境有溫濕度要求的產(chǎn)品,,應(yīng)有與其要求相適應(yīng)的生產(chǎn)環(huán)境和設(shè)施。據(jù)此,,2021年,,農(nóng)業(yè)農(nóng)村部出臺的《獸藥生產(chǎn)許可管理和獸藥GMP檢查驗收有關(guān)細(xì)化要求》中,明確質(zhì)量標(biāo)準(zhǔn)中具有微生物限度檢查項目,、用于乳頭浸泡和手術(shù)器械消毒的產(chǎn)品,,其生產(chǎn)條件應(yīng)按照D級潔凈區(qū)的要求設(shè)置,共涉及22個品種的生產(chǎn)條件發(fā)生了改變,其生產(chǎn)線名稱應(yīng)體現(xiàn)生產(chǎn)區(qū)潔凈度級別,。
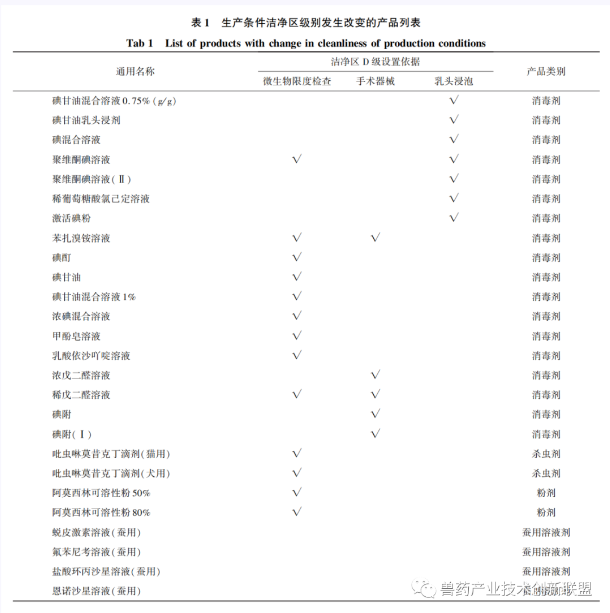
1.5生產(chǎn)線的設(shè)置
2021年,,農(nóng)業(yè)農(nóng)村部辦公廳發(fā)布了修訂后的《獸藥GMP生產(chǎn)線名稱表》,對生產(chǎn)線名稱進(jìn)行了規(guī)范。如產(chǎn)品生產(chǎn)線未在名錄上,,應(yīng)先向部畜牧獸醫(yī)局進(jìn)行新生產(chǎn)線名稱的申請,,獲得新生產(chǎn)線名稱后,才能申請文號,。2022年,,農(nóng)業(yè)農(nóng)村部畜牧獸醫(yī)局新增了6種獸藥GMP生產(chǎn)線,一部分為新獸藥注冊產(chǎn)品的新生產(chǎn)線,分別是噴霧劑(D級),、搽劑(D級),、蠶用溶液劑(D級)、非最終滅菌大容量注射劑(激素類),,另一部分為新生產(chǎn)工藝生產(chǎn)線粉針劑(吹灌封),、最終滅菌小容量注射劑(激素類,吹灌封),。

2.1關(guān)于監(jiān)測期
《獸藥管理條例》第二十一條規(guī)定國務(wù)院獸醫(yī)行政管理部門,,根據(jù)保證動物產(chǎn)品質(zhì)量安全和人體健康的需要,可以對新獸藥設(shè)立不超過5年的監(jiān)測期;在監(jiān)測期內(nèi),,不得批準(zhǔn)其他企業(yè)生產(chǎn)或者進(jìn)口該新獸藥,。
2.1.1監(jiān)測期的計算
新獸藥監(jiān)測期期限分為5年,、4年、3年和不設(shè)監(jiān)測期共4種情況,,監(jiān)測期的設(shè)定需要綜合考慮新獸藥類別,、是否在國內(nèi)外銷售、生產(chǎn)工藝信息等多種因素,。不同質(zhì)量標(biāo)準(zhǔn)的同一通用名稱且靶動物相同的新獸藥,,包括該品種不同規(guī)格,以該新獸藥第一個產(chǎn)品批準(zhǔn)文號生效日期為監(jiān)測期起始日期,。例如:烯丙孕素內(nèi)服溶液分別公布在農(nóng)業(yè)農(nóng)村部公告16,、101、145,、186號及農(nóng)業(yè)部公告2653號中,,烯丙孕素內(nèi)服溶液的監(jiān)測期為4年,第一個產(chǎn)品批準(zhǔn)文號為2018年6月4日批準(zhǔn),,因此該品種的監(jiān)測期為2018.6.4-2022.6.3,。
對于新增靶動物的產(chǎn)品,其監(jiān)測期以獲得新靶動物批準(zhǔn)注冊的日期為監(jiān)測期起始日期,;已有此產(chǎn)品文號的申請人無需申請換發(fā)產(chǎn)品批準(zhǔn)文號,,按照農(nóng)業(yè)農(nóng)村部批準(zhǔn)的標(biāo)簽說明書樣稿自行修改并印制、使用產(chǎn)品標(biāo)簽說明書即可,。
2.1.2監(jiān)測期內(nèi)產(chǎn)品文號的審批
根據(jù)農(nóng)業(yè)部公告第1899號規(guī)定,,監(jiān)測期內(nèi)的新獸藥,每個品種,,包括同一品種的不同規(guī)格,,只能由新獸藥注冊企業(yè)生產(chǎn),但最多不超過3家(必要時,,按注冊排序確定),。新獸藥注冊單位中獸藥生產(chǎn)企業(yè)超過3家的,需提供由所有新獸藥注冊單位蓋章確認(rèn)的監(jiān)測期內(nèi)生產(chǎn)企業(yè)名單,,如所有新獸藥注冊單位確認(rèn)不能就生產(chǎn)權(quán)形成一致意見,,則按新獸藥注冊單位先后排序確定生產(chǎn)企業(yè)名單。在申請文號時,,需提供相關(guān)證明資料,。
對已經(jīng)列入目錄中的進(jìn)口獸藥注冊產(chǎn)品,如果其同品種的新獸藥產(chǎn)品在監(jiān)測期內(nèi),,若其同品種新獸藥尚處在監(jiān)測期內(nèi)的,,可以開展比對試驗,需待同品種過監(jiān)測期后方可進(jìn)行獸藥產(chǎn)品批準(zhǔn)文號申請。
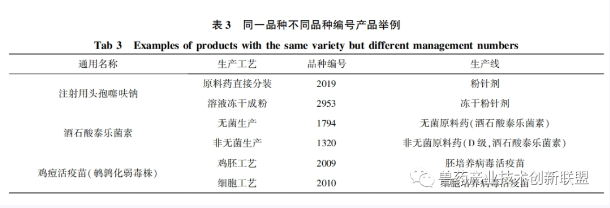
2.2關(guān)于產(chǎn)品品種編號
獸藥產(chǎn)品批準(zhǔn)文號的編制格式為獸藥類別簡稱+9位數(shù)字編碼,。其中前5位為獸藥生產(chǎn)許可證號,,后4位為獸藥品種編號。部分產(chǎn)品雖然通用名一致,,但因生產(chǎn)工藝不同或質(zhì)量標(biāo)準(zhǔn)不同,,需要的生產(chǎn)條件差別很大,。這類產(chǎn)品將根據(jù)生產(chǎn)工藝或質(zhì)量標(biāo)準(zhǔn)分別進(jìn)行品種編號編制,。例如注射用頭孢噻呋鈉(規(guī)格按C19H17N5O7S3計0.1g)質(zhì)量標(biāo)準(zhǔn)為2020CVP-1,存在原料藥直接分裝和溶液凍干成粉兩種完全不同的生產(chǎn)工藝,生產(chǎn)線也分別為粉針劑和凍干粉針劑,。分裝工藝粉針劑品種編號為2019,凍干工藝粉針劑品種編號則為2953,。又如,原料藥酒石酸泰樂菌素,,存在無菌和非無菌兩種質(zhì)量標(biāo)準(zhǔn),。無菌原料藥品種編號為1794,非無菌原料藥品種編號為1320。
2.3關(guān)于比對試驗?zāi)夸洰a(chǎn)品審查
比對試驗?zāi)夸洰a(chǎn)品的研究實際上就是仿制藥的研究過程,,通過自產(chǎn)品和參比品藥學(xué)研究和臨床試驗結(jié)果的比對,,確認(rèn)自產(chǎn)品在效果上與參比品一致。為保證試驗結(jié)果的正確性,,在研究中使用的參比品必須是具有合法來源的,,即已獲得上市批準(zhǔn)的產(chǎn)品。在文號審查中,,無論是市場購買獲得還是贈送獲得,,申請人均需提供參比品批準(zhǔn)信息和購買憑證等合法來源證明。同時,,根據(jù)比對試驗?zāi)夸洸煌a(chǎn)品的要求,,申請人需提供藥學(xué)研究資料和臨床試驗資料,由農(nóng)業(yè)農(nóng)村部新獸藥評審員專家?guī)鞂<疫M(jìn)行評審,。目前比對試驗資料質(zhì)量良莠不齊,,問題集中體現(xiàn)在試驗設(shè)計、技術(shù)標(biāo)準(zhǔn)和資料的完整性,、規(guī)范性方面,。
首先試驗設(shè)計上,比對試驗?zāi)夸浬系漠a(chǎn)品為進(jìn)口獸藥注冊和新獸藥注冊產(chǎn)品,,在發(fā)布注冊審批公告時,,產(chǎn)品的生產(chǎn)工藝和質(zhì)量標(biāo)準(zhǔn)因知識產(chǎn)權(quán)保護(hù)的原因并不公開,申請人的研究應(yīng)聚焦在自研品與參比品在安全性和有效性的比較研究上,,而不是單純質(zhì)量標(biāo)準(zhǔn)的比較研究,,無法獲得參比品的質(zhì)量標(biāo)準(zhǔn)會影響自研品的研制是不成立的。其次,研制比對試驗?zāi)夸洰a(chǎn)品的本質(zhì)就是仿制,,其藥學(xué)研究和臨床試驗的技術(shù)要求應(yīng)與新獸藥注冊中的三類原料藥仿制藥和五類制劑仿制藥一致,,并不因?qū)徟芾矸绞降牟煌煌湓u審尺度與獸藥注冊評審尺度是一致的,。對比對試驗?zāi)夸洰a(chǎn)品研究資料的評審是降低了技術(shù)標(biāo)準(zhǔn)的“小評審”,,這種想法是不正確的。三是研究資料的完整性和規(guī)范性上失誤較多,,如研究圖譜提供不完整,、文字描述與圖表信息不一致等,沒有提供有效目錄,、英文縮略語有誤,、計算錯誤或數(shù)據(jù)單位有誤等所謂的“小”問題,同樣會影響文號審批的整體進(jìn)度,。
2.4關(guān)于特殊品種生產(chǎn)線要求
產(chǎn)品需要在《獸藥生產(chǎn)許可證》載明的生產(chǎn)范圍內(nèi),,符合要求的生產(chǎn)線上生產(chǎn)。一些特殊的產(chǎn)品僅從通用名稱上看,,很容易混淆生產(chǎn)線,。例如,硫酸鋅粉(水產(chǎn)用),,容易認(rèn)為生產(chǎn)線為粉劑,,其實它的用途是殺蟲劑,符合要求的生產(chǎn)線應(yīng)為“外用殺蟲劑(固體)”,。硫代硫酸鈉粉(水產(chǎn)用),、過氧化鈣粉(水產(chǎn)用)等產(chǎn)品的生產(chǎn)線應(yīng)為“消毒劑(固體)”。滅蠶蠅溶液的生產(chǎn)線應(yīng)為“蠶用溶液劑”而非外用殺蟲劑(液體),。此外,,氟尼辛葡甲胺注射液也是非常特殊的產(chǎn)品,該注射劑生產(chǎn)線如為“最終滅菌大容量靜脈注射劑”,,方可在標(biāo)簽和說明書【用法與用量】中印制靜脈注射相關(guān)內(nèi)容,。
獸藥產(chǎn)品批準(zhǔn)文號審批為產(chǎn)品上市的最后一道關(guān)口。獸藥產(chǎn)業(yè)政策調(diào)整,、獸藥GMP技術(shù)標(biāo)準(zhǔn)發(fā)展,、產(chǎn)品質(zhì)量標(biāo)準(zhǔn)提高和監(jiān)管需求變化均會影響文號審批。隨著行業(yè)發(fā)展,,獸藥研發(fā),、生產(chǎn)、文號管理從環(huán)環(huán)緊扣到日益融合,,獸藥文號審批向著“注冊制”轉(zhuǎn)變的趨勢已經(jīng)逐漸形成,。申請文號需要提交的資料將由生產(chǎn)工藝規(guī)程文件性資料向產(chǎn)品工藝,、質(zhì)量研究資料轉(zhuǎn)變。這一點可以從2023年1月管理部門公開征求《獸藥產(chǎn)品批準(zhǔn)文號管理辦法(部分修訂征求意見稿)》內(nèi)容可見一斑,。獸藥管理模式的變化也將從根本上降低產(chǎn)品同質(zhì)化,、提升產(chǎn)業(yè)集中度、解決批準(zhǔn)文號“閑置”的問題,。未來,,獸藥研發(fā)、生產(chǎn)的技術(shù)標(biāo)準(zhǔn)將更加嚴(yán)謹(jǐn),,研發(fā)成果轉(zhuǎn)化更加高效,,獸藥監(jiān)管更加精準(zhǔn),安全有效,、質(zhì)量可控的獸藥作為養(yǎng)殖投入品,,從源頭上保障畜禽產(chǎn)品質(zhì)量和人民群眾“舌尖上的安全”。
免責(zé)聲明
本欄目旨在信息共享交流,,此文版權(quán)歸原作者及期刊所有,若有來源錯誤或者侵犯您的合法權(quán)益,,請及時聯(lián)系我們,。
本文內(nèi)容節(jié)選自《中國獸藥雜志》2023年10月第57卷第10期
作者:中國獸醫(yī)藥品監(jiān)察所 安洪澤,馮克清,,陳莎莎,,吳 濤
國家獸藥產(chǎn)業(yè)技術(shù)創(chuàng)新聯(lián)盟 National veterinary drug industry technology innovation alliance |
掃一掃  |
| 聯(lián)系電話:010-62103991轉(zhuǎn)611 聯(lián)系地址:北京市海淀區(qū)中關(guān)村南大街8號 備案:京ICP備20024024號 |