mRNA疫苗技術(shù)具備研發(fā)周期短,、安全性優(yōu)良、生產(chǎn)技術(shù)通用性強(qiáng)的特點(diǎn),,但由于mRNA疫苗的特殊工藝,傳統(tǒng)的生物制品廠房設(shè)計(jì)已不能完全滿足其制備要求,??茖W(xué)合理的廠房工藝設(shè)計(jì)是確保mRNA疫苗產(chǎn)能與質(zhì)量的主要條件,因此,,如何設(shè)計(jì)既符合工藝要求又滿足獸藥GMP的動(dòng)物mRNA疫苗生產(chǎn)廠房成為擺在我們面前急需探究的課題,。鑒于不同國(guó)家在能源結(jié)構(gòu)、環(huán)保要求,、設(shè)計(jì)理念等方面存在差異,,在借鑒歐美已有的mRNA疫苗規(guī)模化生產(chǎn)設(shè)施和我國(guó)人用mRNA疫苗廠房設(shè)計(jì)的基礎(chǔ)上,,提出了符合我國(guó)獸藥GMP規(guī)范的mRNA疫苗廠房生產(chǎn)設(shè)施,、工藝關(guān)鍵點(diǎn)和設(shè)計(jì)方案,以期為國(guó)內(nèi)動(dòng)物mRNA疫苗車間建設(shè)提供參考,。
[關(guān)鍵詞]動(dòng)物,;mRNA疫苗,;生產(chǎn)設(shè)施;工藝設(shè)計(jì),;GMP
mRNA疫苗技術(shù)是疫苗開(kāi)發(fā)領(lǐng)域的一項(xiàng)重大進(jìn)展,,具備高效、研發(fā)周期短,、安全性優(yōu)良,、生產(chǎn)技術(shù)通用性強(qiáng)的特點(diǎn)。mRNA技術(shù)是一種將人工合成的mRNA分子引入細(xì)胞內(nèi),,并利用細(xì)胞自身的翻譯機(jī)制來(lái)將其轉(zhuǎn)錄成蛋白質(zhì)的技術(shù),,已有幾十年的研究歷史。新冠疫情暴發(fā)后,,Moderna利用該技術(shù)僅用了42天即完成了新冠mRNA候選疫苗mRNA-1273的構(gòu)建和篩選,,并于2020年3月獲得FDA批準(zhǔn)正式開(kāi)始評(píng)估安全性和免疫原性的I期臨床試驗(yàn),試驗(yàn)結(jié)果顯示該候選株的免疫保護(hù)性可達(dá)94.1%,。2020年12月輝瑞和Moderna分別研制的mRNA疫苗均獲得美國(guó)食品安全局的緊急使用授權(quán)(EUA),成為疫苗史上最快研制上市的疫苗,標(biāo)志著mRNA技術(shù)正式應(yīng)用到COVID-19臨床預(yù)防,。隨著mRNA技術(shù)的發(fā)展以及在新冠疫情防控中的應(yīng)用,該技術(shù)成為生物醫(yī)學(xué)領(lǐng)域的研究熱點(diǎn),,得到了極大的關(guān)注,,并獲得了2023年諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)。作為一種潛力巨大的新型技術(shù),,無(wú)論是出于預(yù)防目的還是治療用途,,以及作為新型治療藥物的基礎(chǔ),諸多國(guó)內(nèi)外企業(yè)正快速推進(jìn)相關(guān)mRNA制品的研究與應(yīng)用,。截至2023年12月,,美國(guó)ModernaTherapeutics公司原研的mRNA疫苗產(chǎn)品數(shù)量最多,一共有28個(gè),;美國(guó)的AlphaVax公司和比利時(shí)的ZiphiusVaccines公司原研疫苗各10個(gè),;中國(guó)的斯微生物(StemiRNA)和蘇州艾博生物(AnbogenBiosciences)公司分別有9個(gè)和2個(gè)產(chǎn)品在研,其中包括艾博生物的ARCoVax疫苗和麗凡達(dá)生物旗下的LVRNA009,這兩種疫苗都已經(jīng)步入了Ⅲ期臨床試驗(yàn)。沃森生物,、石藥集團(tuán)等研究成功的新冠mRNA疫苗于2023年12月被我國(guó)國(guó)家藥監(jiān)局獲批納入緊急使用,。mRNA疫苗是通過(guò)合成和轉(zhuǎn)錄等技術(shù)制備得到的核酸制劑,通過(guò)特定的遞送系統(tǒng)將外源的目的基因序列導(dǎo)入機(jī)體細(xì)胞,,從而表達(dá)目的蛋白并激發(fā)機(jī)體產(chǎn)生特異性免疫反應(yīng),,以實(shí)現(xiàn)免疫保護(hù)。mRNA注射進(jìn)入體內(nèi)發(fā)揮作用,,但其本身不進(jìn)入細(xì)胞核,,避免了外源性DNA污染的風(fēng)險(xiǎn),具備較高的安全性,。與傳統(tǒng)疫苗相比,,mRNA疫苗采用DNA模板并通過(guò)無(wú)細(xì)胞酶促轉(zhuǎn)錄反應(yīng)進(jìn)行生產(chǎn),。這種生產(chǎn)工藝相對(duì)簡(jiǎn)單,能夠快速實(shí)現(xiàn)大規(guī)模生產(chǎn),。同時(shí),,mRNA疫苗的配方設(shè)計(jì)和生產(chǎn)步驟具備可復(fù)制性,有助于縮短研發(fā)生產(chǎn)周期,。當(dāng)前,,國(guó)內(nèi)動(dòng)物mRNA研發(fā)的積極性很高,急需根據(jù)mRNA疫苗產(chǎn)業(yè)化生產(chǎn)工藝相對(duì)穩(wěn)定的特點(diǎn),,結(jié)合相關(guān)法規(guī)要求,,借鑒并參考人mRNA疫苗車間設(shè)計(jì)理念,通過(guò)全面分析人mRNA疫苗產(chǎn)業(yè)化車間功能區(qū)布局、潔凈區(qū)域劃分,、人流和物流走向,、壓差分布以及氣流方向等方面特點(diǎn)要求,在探究動(dòng)物mRNA疫苗廠房工藝設(shè)計(jì)的關(guān)鍵點(diǎn)與核心要素的基礎(chǔ)上,,提出可供參考的方案,以期為國(guó)內(nèi)動(dòng)物mRNA疫苗生產(chǎn)廠房的建設(shè)與管理提供參考,。
從人用mRNA疫苗車間看,,制造mRNA疫苗的過(guò)程一般分為三個(gè)關(guān)鍵階段:首先是質(zhì)粒DNA(plasmidDNA,pDNA)模板的制備,接著是mRNA藥物成分(drugsubstance,DS)的合成,,最后是其裝載入傳遞系統(tǒng)并完成制劑的最終灌裝,。這一系列步驟中至關(guān)重要的是從pDNA模板的生產(chǎn)到mRNA藥物物質(zhì)的合成等核心工藝的工程設(shè)計(jì)。
在產(chǎn)業(yè)化規(guī)模下,,pDNA的生產(chǎn)通常采用大腸桿菌為宿主的系統(tǒng)進(jìn)行,。這個(gè)流程包括大腸桿菌的發(fā)酵作為上游過(guò)程,繼而是收集與裂解菌體,,最后是下游的pDNA提純和溶液的灌裝,。在經(jīng)過(guò)優(yōu)化構(gòu)建的pDNA系統(tǒng)中,目標(biāo)質(zhì)粒在大腸桿菌中通過(guò)發(fā)酵過(guò)程被表達(dá),,接著通過(guò)裂解過(guò)程釋放到培養(yǎng)上清液中,。后續(xù)的澄清過(guò)濾及色譜純化等步驟將用于去除細(xì)胞殘留物、RNA和線性DNA等雜質(zhì),。目前,,pDNA的生產(chǎn)技術(shù)相對(duì)成熟,并已有詳盡的操作流程,。
mRNADS的生產(chǎn)工藝包含數(shù)個(gè)關(guān)鍵步驟:起始于上游的pDNA線性化,,隨后進(jìn)行體外轉(zhuǎn)錄(invitrotranscription,IVT),然后進(jìn)入下游的mRNA純化過(guò)程,以及最終的原液灌裝,。在這其中,,特別需要注意的是,,pDNA的生產(chǎn)過(guò)程最終產(chǎn)出的是超級(jí)螺旋(supercoiled)pDNA,這種形式的pDNA比線性化的pDNA結(jié)構(gòu)更加穩(wěn)定,更適合長(zhǎng)期儲(chǔ)存,。盡管如此,,如果通過(guò)驗(yàn)證確認(rèn)線性化pDNA在特定條件下能夠保持穩(wěn)定性,線性化過(guò)程可作為pDNA制造后的一個(gè)附加步驟,。這樣獲得的線性化pDNA可在凍存之后直接應(yīng)用于IVT過(guò)程,。
目前,mRNA藥物成分(DS)的生產(chǎn)過(guò)程尚未形成一套通用和標(biāo)準(zhǔn)化的生產(chǎn)流程,,市場(chǎng)上已上市或正在開(kāi)發(fā)中的產(chǎn)品采取了不同的生產(chǎn)技術(shù)路徑,,包括上游合成、下游處理方面,,如圖1A所示,。目前在人藥有兩種獲得批準(zhǔn)的mRNA疫苗生產(chǎn)方法,其上游合成階段的差異是用于加成5’帽的技術(shù)選擇不同,一種是在轉(zhuǎn)錄過(guò)程中同時(shí)進(jìn)行帽的添加(共轉(zhuǎn)錄加帽,,即一步法),,而另一種方法則是在轉(zhuǎn)錄完成后再加帽(轉(zhuǎn)錄后加帽,即二步法),,如圖1B所示,。
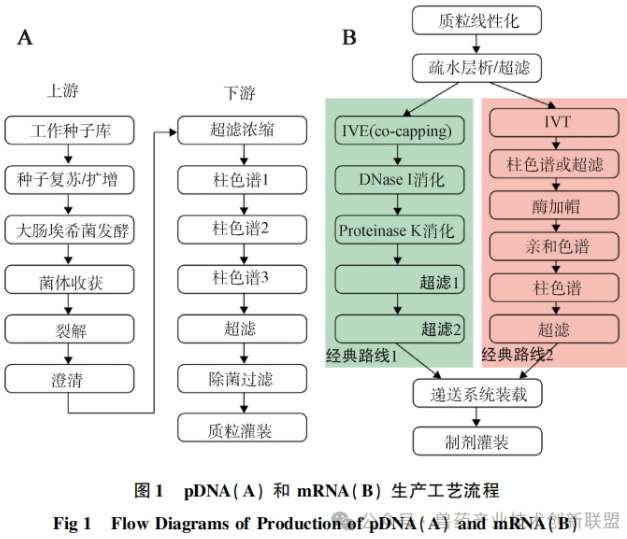
在制備mRNA疫苗時(shí),一步法是在IVT的同時(shí)結(jié)合引物,,類似于BioNTech公司用于BNT162b2疫苗的技術(shù),;二步法則是先進(jìn)行IVT,隨后加入加帽酶進(jìn)行結(jié)合,這是Moderna公司在生產(chǎn)其mRNA-1273疫苗時(shí)所采用的技術(shù),。
在純化mRNA的過(guò)程中,,不同的公司采用的方法不盡相同。一般研究中的純化過(guò)程通常采納類似于Moderna公司使用的雙色譜分離技術(shù),。純化的第一階段是使用OligodT親和色譜法,,它依賴于OligodT與mRNA的polyA尾端的特異性結(jié)合,以實(shí)現(xiàn)從合成混合物中分離mRNA,從而有效移除未參與反應(yīng)的試劑和DNA模板等,。但是,,這個(gè)步驟不能清除大量的雙鏈RNA(dsRNA)。純化的第二階段通常采用疏水色譜或離子交換色譜技術(shù),,這些技術(shù)有助于除去可能激發(fā)人體免疫反應(yīng)的dsRNA和截短的RNA雜質(zhì),。去除dsRNA雜質(zhì),還可以使用反相離子對(duì)色譜法,,這種辦法對(duì)dsRNA的清除率相對(duì)較高,,但這種方法大量使用有機(jī)溶劑。因此研究應(yīng)用時(shí),,對(duì)環(huán)境可能造成的影響也需納入考量,。
鑒于mRNA疫苗生產(chǎn)過(guò)程并沒(méi)有完全統(tǒng)一的路線,,現(xiàn)階段生產(chǎn)車間的設(shè)計(jì)必須具備一定的靈活性,以適應(yīng)后續(xù)可能出現(xiàn)的各種不同的制造工藝需求,。mRNA疫苗的生產(chǎn)規(guī)模和產(chǎn)能
mRNA因其針對(duì)的目標(biāo)和途徑的不同而需要不同的生產(chǎn)規(guī)模,。例如,在應(yīng)對(duì)全球性流行病時(shí)用于預(yù)防的COVID-19疫苗需求量可達(dá)到數(shù)十億劑量,。而對(duì)于其他種類的傳染病,,比如季節(jié)性流感或特定類型腫瘤的預(yù)防和治療疫苗,雖然它們可能需要適配更多的治療方式,,但每個(gè)特定應(yīng)用的人群規(guī)模預(yù)計(jì)將達(dá)數(shù)百萬(wàn),。除此之外,還存在著對(duì)極為專門化治療需求的個(gè)性化療法,,這可能涉及到對(duì)單個(gè)特種病定制的產(chǎn)品,,其生產(chǎn)規(guī)模相對(duì)較小,僅為微克到毫克級(jí)別,。參考市場(chǎng)上已獲批準(zhǔn)的BioNTech/Pfizer和Moderna的COVID-19mRNA疫苗的產(chǎn)品信息(見(jiàn)表1),并以每年生產(chǎn)10億劑疫苗的生產(chǎn)規(guī)模為案例,,深入分析相關(guān)工藝設(shè)計(jì)問(wèn)題。

根據(jù)文獻(xiàn),基于規(guī)劃的年度產(chǎn)能目標(biāo),,設(shè)定為mRNA物質(zhì)每年30kg,。采用反應(yīng)轉(zhuǎn)化率為100、以及過(guò)程收率為70%的參數(shù)進(jìn)行產(chǎn)能需求計(jì)算,,得出所需pDNA的年度產(chǎn)能為428.6g。在每個(gè)生產(chǎn)批次中,,若投入4.3g的pDNA,并且按照70%的過(guò)程收率計(jì)算,,每批能收獲的mRNA為301g??紤]到mRNA的單批生產(chǎn)周期為3天,,一年內(nèi)可進(jìn)行約100個(gè)生產(chǎn)批次。據(jù)此估計(jì),,mRNA的年度產(chǎn)能至少達(dá)到或超過(guò)30.1kg,從而才能滿足預(yù)定的年度產(chǎn)能要求,。
綜合上文分析,pDNA年度產(chǎn)能需求為每年428.6g,。應(yīng)用體積為50L的發(fā)酵罐進(jìn)行生產(chǎn)時(shí),,考慮到pDNA的表達(dá)量為0.2g/L,并且以50%的收率估算,預(yù)計(jì)每一批次產(chǎn)出約為5g的pDNA[16],。假設(shè)每批pDNA的生產(chǎn)周期為5天,,并且批次之間的生產(chǎn)間隔設(shè)定為3.5天,那么在一個(gè)年度周期內(nèi),,至少可以完成88個(gè)生產(chǎn)批次,。據(jù)此,,年度pDNA產(chǎn)量至少需要達(dá)到440g,才能充分滿足年度產(chǎn)能要求。
在不對(duì)現(xiàn)有生產(chǎn)設(shè)施進(jìn)行改進(jìn)的前提下,,通過(guò)減少年度生產(chǎn)批次,,可將生產(chǎn)班次從三班制調(diào)整為兩班制,或是調(diào)降mRNA藥物成分(DS)生產(chǎn)過(guò)程中單批次的投料量至使得體外轉(zhuǎn)錄(IVT)過(guò)程中藥物濃度維持在2~5g/L的水平,,實(shí)現(xiàn)生產(chǎn)線的靈活調(diào)整,,以支持每年生產(chǎn)最多7500萬(wàn)劑(每劑100μg)的疫苗。這樣的產(chǎn)能能夠滿足預(yù)防和治療目的mRNA疫苗的目標(biāo)群覆蓋需求,。
人mRNA疫苗生產(chǎn)廠房設(shè)計(jì)示例
根據(jù)文獻(xiàn)資料就人用mRNA疫苗生產(chǎn)制造工藝布局,、人員與物料流向、潔凈區(qū)的劃分,、壓力設(shè)計(jì)和氣流走向等要素進(jìn)行分析介紹,,見(jiàn)圖2。
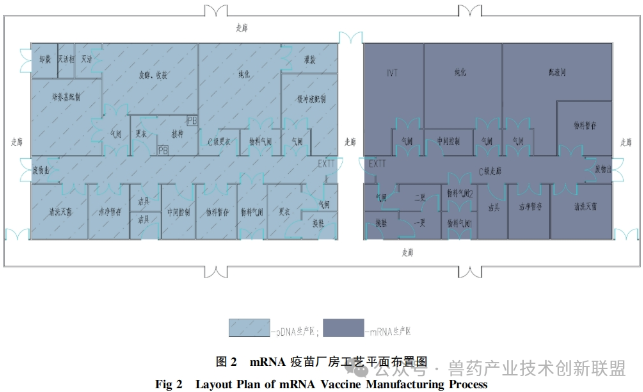
在生產(chǎn)布局規(guī)劃中,,設(shè)置兩個(gè)生產(chǎn)區(qū)域:一個(gè)是50L規(guī)模的質(zhì)粒生產(chǎn)區(qū),,另一個(gè)是同樣規(guī)模的mRNA藥物成分(DS)生產(chǎn)區(qū)。與傳統(tǒng)的抗體制造設(shè)備相比,,這些設(shè)備的規(guī)模較小,。要求無(wú)菌條件下進(jìn)行的灌裝工作必須在無(wú)菌車間內(nèi)進(jìn)行,而這一部分的工藝設(shè)計(jì)已經(jīng)相當(dāng)成熟,,因此重點(diǎn)關(guān)注pDNA和mRNADS的生產(chǎn)過(guò)程的工藝布局,。生產(chǎn)無(wú)菌的mRNADS對(duì)環(huán)境條件有較高要求,在工藝布局設(shè)計(jì)時(shí)將其與大腸桿菌的生產(chǎn)線徹底隔離,,并單獨(dú)設(shè)置,,使用不同的空調(diào)系統(tǒng),防止交叉污染,。如圖2展示的,,左側(cè)區(qū)域是pDNA的生產(chǎn)區(qū)域,而右側(cè)是mRNADS的生產(chǎn)區(qū)域,。pDNADS的生產(chǎn)線包括以下功能間:接種間,、發(fā)酵和收獲間、純化間以及灌裝間,。與此同時(shí),,培養(yǎng)基的配制間與上游工段鄰接,而緩沖液的配制間則緊鄰下游工段,,以實(shí)現(xiàn)物料傳輸?shù)淖疃叹嚯x,。其他輔助空間包括清洗和滅菌間,以及微生物廢物滅活間等。在mRNADS的生產(chǎn)車間中,,關(guān)鍵工序操作間主要包括IVT間,、純化間,配液間與純化間相鄰,,方便使用,。此外,還配備了清洗和滅菌間,,中間過(guò)程的控制室,,以及材料暫存間等輔助功能間。傳統(tǒng)工藝布局理念,,可以按照類似于實(shí)驗(yàn)室的“大通間”設(shè)計(jì)思路用在mRNADS的生產(chǎn)車間設(shè)計(jì)方面,,即把IVT和純化過(guò)程安置在同一功能間內(nèi)。這種布局具有工藝切換靈活,、節(jié)約空間等優(yōu)勢(shì),,但是需要對(duì)潛在的上下游交叉污染問(wèn)題進(jìn)行充分的風(fēng)險(xiǎn)評(píng)估。
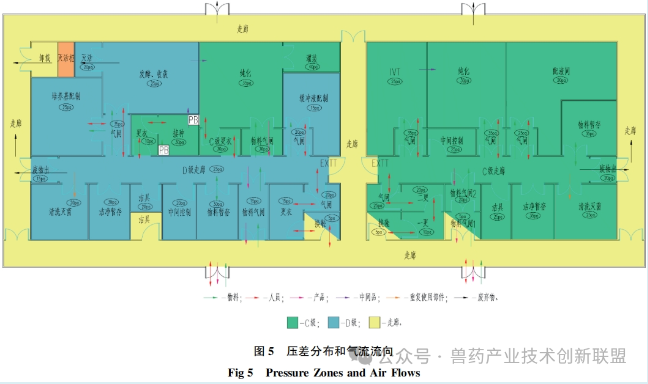
生產(chǎn)pDNA時(shí)對(duì)操作環(huán)境潔凈度的設(shè)置,,遵循GMP要求,。在pDNA生產(chǎn)過(guò)程中,用于培養(yǎng)大腸桿菌其所在背景環(huán)境為C級(jí)潔凈區(qū),。發(fā)酵過(guò)程若是封閉操作,,所推薦的潔凈級(jí)別為D級(jí)以上。在純化階段,,可在C級(jí)環(huán)境下進(jìn)行,。如圖3所描述,人員與物料的出入口設(shè)有氣閘間,。通過(guò)在人員或物料進(jìn)出時(shí)控制空氣流動(dòng),,盡可能降低微生物及其他污染源的介入。在換穿潔凈服之后,,pDNA生產(chǎn)人員進(jìn)入D級(jí)潔凈區(qū)的走廊,在前往接種間之前,,需更C級(jí)潔凈衣,。與此類似,純化室的工作人員在進(jìn)入相關(guān)功能間之前,,同樣需更C級(jí)潔凈衣,。物料通過(guò)專設(shè)的物料氣閘間,經(jīng)過(guò)外清潔后進(jìn)入潔凈區(qū),。廢棄物由專設(shè)廢物氣閘間轉(zhuǎn)出,,接著被運(yùn)送至北側(cè)。此類平面布局通過(guò)氣閘間將發(fā)酵間、純化間等可能產(chǎn)生污染的區(qū)域隔離開(kāi)來(lái),,確保D級(jí)共用通道的相對(duì)潔凈狀態(tài),。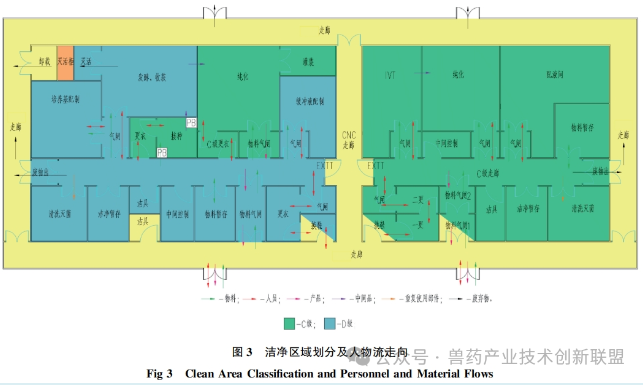
在mRNADS的生產(chǎn)區(qū),由于最終產(chǎn)品需經(jīng)無(wú)菌過(guò)濾,,因此整個(gè)制造區(qū)是按照C級(jí)潔凈標(biāo)準(zhǔn)而設(shè)計(jì)的,,以控制過(guò)程中的生物載量。在其進(jìn)出口同樣設(shè)有供人員及物料專用的氣閘間,。在更C級(jí)潔凈服后,,人員可進(jìn)入C級(jí)潔凈區(qū)走廊及其它功能空間。IVT和純化是兩個(gè)關(guān)鍵的核心功能間,,通過(guò)設(shè)置氣閘間來(lái)降低交叉污染的風(fēng)險(xiǎn),。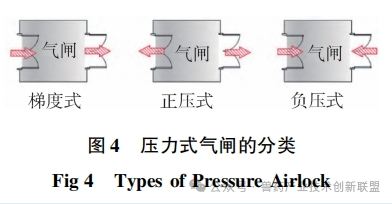
潔凈室入口處的氣閘室設(shè)計(jì)起著關(guān)鍵作用,其遮擋外部的污染空氣并且調(diào)整壓力差異,。根據(jù)空間的特定需要,,設(shè)置梯度式(cascade)氣閘間、正壓式(bubble)氣閘間和負(fù)壓式(sink)氣閘間等多種形式,,如圖4所示,。梯度式(cascade)氣閘間適用于需要保持一定潔凈等級(jí)但無(wú)隔離需求的場(chǎng)所,或者有隔離需求但不要求嚴(yán)格潔凈度的場(chǎng)所,。正壓和負(fù)壓風(fēng)閘適宜用在既有潔凈度要求又需產(chǎn)品隔離的場(chǎng)合,。如圖5所示,mRNADS的更衣空間采取了漸變壓力風(fēng)閘設(shè)計(jì),,用以確保合適的潔凈水平,。C級(jí)通道與各關(guān)鍵功能區(qū)之間,正壓風(fēng)閘的設(shè)置有助于阻止區(qū)域間空氣交叉流通,,保持潔凈室內(nèi)的潔凈等級(jí),,并有效避免各操作間的空氣外泄。與此相似,,pDNA生產(chǎn)區(qū)域以及發(fā)酵和收獲間與D級(jí)通道之間也采用正壓氣閘設(shè)計(jì),,以防止?jié)撛诘膸Ь諝馕廴?span style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 17px; font-family: Calibri;">D級(jí)潔凈走廊。純化間則涉及pDNA原液的無(wú)菌過(guò)濾與包裝,,因此與D級(jí)潔凈走廊之間應(yīng)用了梯度式氣閘間,,確保氣流從純化區(qū)向D級(jí)潔凈走廊流動(dòng),預(yù)防走廊內(nèi)的氣流倒流,,避免影響產(chǎn)品的質(zhì)量,。
人mRNA疫苗車間設(shè)計(jì)理念對(duì)動(dòng)物mRNA疫苗車間設(shè)計(jì)的啟示筆者通過(guò)對(duì)國(guó)內(nèi)外人藥法規(guī)管理以及資料、文獻(xiàn)查詢,,結(jié)合對(duì)國(guó)內(nèi)某公司的mRNA疫苗生產(chǎn)車間進(jìn)行了調(diào)研和學(xué)習(xí)交流,,根據(jù)獸藥GMP相關(guān)要求,,對(duì)動(dòng)物mRNA疫苗生產(chǎn)線的工藝布局進(jìn)行了探究與思考,提出了供獸藥行業(yè)參考的建議,。4.1關(guān)于mRNA疫苗生產(chǎn)工藝mRNA疫苗的制造始于以pDNA為模板的過(guò)程,,通過(guò)酶的作用,從pDNA轉(zhuǎn)錄出mRNA,。歐盟法規(guī)允許生物技術(shù)公司將此類pDNA的制作外包給專業(yè)的合同制造機(jī)構(gòu)(contractmanufactureorganization,CMO),并把這一環(huán)節(jié)作為原材料監(jiān)控的一個(gè)部分,。與此不同,《中華人民共和國(guó)疫苗管理法》及《新型冠狀病毒預(yù)防用疫苗研發(fā)技術(shù)指導(dǎo)原則(試行)》規(guī)定,,在中國(guó)境內(nèi),,pDNA模板被歸類為原液生產(chǎn)的一部分,要求相關(guān)企業(yè)必須自行制造pDNA。而我國(guó)動(dòng)物疫苗GMP管理實(shí)踐中,,也需將其作為生產(chǎn)的一部分,。鑒于這些差異以及對(duì)技術(shù)平臺(tái)完善性及將來(lái)應(yīng)用的靈活性的考慮,動(dòng)物mRNA疫苗的制造流程可從pDNA的制備著手,,重點(diǎn)關(guān)注pDNA與mRNA原液制備的關(guān)鍵工藝流程和與其相應(yīng)的工藝工程設(shè)計(jì)細(xì)節(jié),。
4.2關(guān)于動(dòng)物mRNA疫苗車間生產(chǎn)線分區(qū)根據(jù)目前動(dòng)物mRNA疫苗的生產(chǎn)工藝,其生產(chǎn)線核心功能區(qū)通??煞譃?span style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; font-size: 17px; font-family: Calibri;">5個(gè)區(qū)域(平面布局參見(jiàn)圖6):發(fā)酵和收獲區(qū),、pDNA純化區(qū)、IVT區(qū),、LNP區(qū)和無(wú)菌罐裝區(qū),,這5個(gè)區(qū)域應(yīng)分別設(shè)置且相互獨(dú)立,不同區(qū)域的人流和物流應(yīng)分開(kāi)設(shè)置,,與mRNA疫苗生產(chǎn)相配套的倉(cāng)儲(chǔ)區(qū)和質(zhì)檢區(qū)可參考常規(guī)獸藥GMP的工藝設(shè)計(jì),。
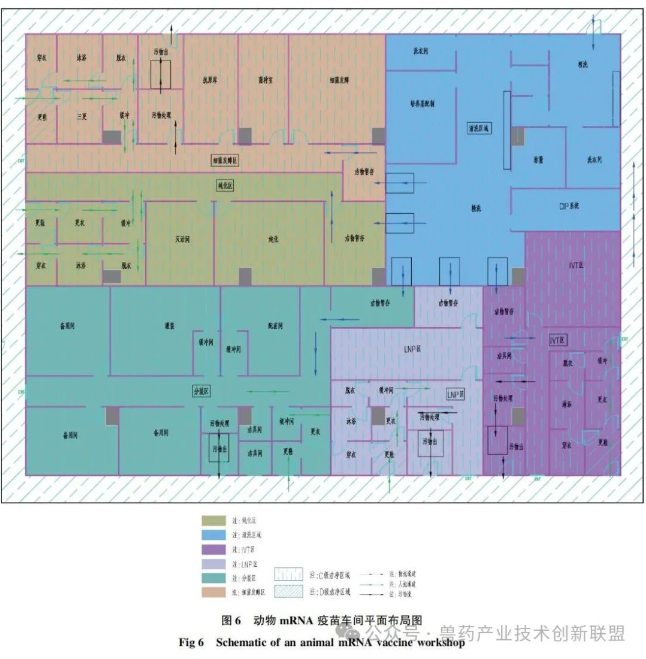
發(fā)酵和收獲區(qū),主要是采用不同規(guī)格的發(fā)酵罐對(duì)大腸桿菌進(jìn)行發(fā)酵,,然后通過(guò)碟片離心機(jī)或冷凍離心機(jī)收集菌體,,再對(duì)菌體進(jìn)行裂解,離心后收集上清,。pDNA純化區(qū),,主要是通過(guò)超濾濃縮-層析-超濾等方式對(duì)獲得的pDNA進(jìn)行逐級(jí)純化,在純化區(qū)的末端可設(shè)置酶切反應(yīng)罐,,對(duì)純化后的pDNA進(jìn)行線性化,。IVT區(qū),主要是對(duì)pDNA進(jìn)行體外轉(zhuǎn)錄,,然后超濾或者層析,進(jìn)行加帽修飾,,親和層析,,最后再經(jīng)過(guò)一次超濾后,保存或進(jìn)入下一道工序。LNP區(qū),,主要是對(duì)體外轉(zhuǎn)錄后的mRNA進(jìn)行包裝,,通常采用微流體動(dòng)力學(xué)技術(shù)將mRNA和LNPs混合,使mRNA被脂質(zhì)顆粒所包裹,,根據(jù)需要可加入防凍劑等穩(wěn)定劑,。無(wú)菌罐裝區(qū),主要是將制劑灌裝到小瓶或預(yù)裝式注射器中,。4.4關(guān)于質(zhì)量控制及其他功能間
除了生產(chǎn)車間配置之外,,mRNA疫苗的生產(chǎn)還需輔以適當(dāng)?shù)馁|(zhì)量控制(qualitycontrol,QC)實(shí)驗(yàn)室,以進(jìn)行原料,、中間產(chǎn)物和最終產(chǎn)品的檢測(cè)工作,。例如,在pDNA生產(chǎn)時(shí)對(duì)細(xì)菌種子的檢測(cè),、超螺旋質(zhì)粒的純度,、殘留和微生物限度的質(zhì)量控制等。同時(shí),,車間所使用的部分原料和輔料,,比如特定的酶,可能需要在特定溫度下儲(chǔ)存,;與此類似,,mRNA疫苗的原液和成品也對(duì)保存溫度有明確要求。例如,,BioNTech/Pfizer的疫苗最終產(chǎn)品需儲(chǔ)存在-80~-60℃的條件下,,而Moderna的mRNA疫苗最終產(chǎn)品的儲(chǔ)存溫度為-25~-15℃。由此,,存儲(chǔ)區(qū)域需配備相匹配的冷藏設(shè)備,,比如冰箱或冷庫(kù),工藝布局設(shè)計(jì)中需包含這一考量,。此外,,在遞送系統(tǒng)的裝載過(guò)程中,可能會(huì)使用甲級(jí)的乙醇溶液進(jìn)行稀釋,,這就需要考慮防爆的標(biāo)準(zhǔn)和措施,。
mRNA疫苗目前正在進(jìn)入從實(shí)驗(yàn)室研究向產(chǎn)業(yè)化生產(chǎn)的轉(zhuǎn)型期,展現(xiàn)出巨大的市場(chǎng)潛力,。然而,,它仍須跨越多項(xiàng)技術(shù)難關(guān)才能成功實(shí)現(xiàn)。迄今,,人藥物領(lǐng)域國(guó)外只有Moderna,、BioNTech/Pfizer的COVID-19mRNA疫苗分別獲得了FDA和EMA等監(jiān)管機(jī)構(gòu)的緊急使用授權(quán),,國(guó)內(nèi)只有沃森生物、石藥集團(tuán)等研發(fā)的新冠mRNA疫苗被國(guó)家藥監(jiān)局批準(zhǔn)納入緊急使用,。相比之下,,動(dòng)物mRNA疫苗研發(fā)大多停留在臨床前研究階段,缺乏在獸用GMP標(biāo)準(zhǔn)下進(jìn)行產(chǎn)業(yè)化生產(chǎn)經(jīng)驗(yàn),,同時(shí)也缺少相關(guān)的質(zhì)量控制和監(jiān)管先例作為參照,。工廠設(shè)計(jì)應(yīng)既具備前瞻性,以應(yīng)對(duì)潛在的生產(chǎn)能力擴(kuò)張,,同時(shí)又需避免過(guò)度設(shè)計(jì),,以免造成初期投資過(guò)高。這要求對(duì)疫苗產(chǎn)品本身的特性及市場(chǎng)未來(lái)的發(fā)展趨勢(shì)有充分的了解和預(yù)判,。本研究旨在為國(guó)內(nèi)動(dòng)物mRNA疫苗生產(chǎn)平臺(tái)的建設(shè)和發(fā)展提供思路,。









