 |
國家獸藥產(chǎn)業(yè)技術(shù)創(chuàng)新聯(lián)盟 National veterinary drug industry technology innovation alliance |
用戶登錄
聯(lián)系我們
|
<abbr id="gaa4w"></abbr>
<optgroup id="gaa4w"></optgroup>  |
國家獸藥產(chǎn)業(yè)技術(shù)創(chuàng)新聯(lián)盟 National veterinary drug industry technology innovation alliance |
用戶登錄
聯(lián)系我們
|
服務(wù)創(chuàng)造價值、存在造就未來
中獸藥,、天然藥物分類及注冊資料要求
一,、注冊分類及說明
(一)注冊分類
第一類 未在國內(nèi)上市銷售的原藥及其制劑,。
1.從中藥、天然藥物中提取的有效成份及其制劑,;
2.來源于植物,、動物、礦物等藥用物質(zhì)及其制劑,;
3.中藥材代用品,。
第二類 未在國內(nèi)上市銷售的部位及其制劑。
1.中藥材新的藥用部位制成的制劑,;
2.從中藥,、天然藥物中提取的有效部位制成的制劑。
第三類 未在國內(nèi)上市銷售的制劑,。
1.傳統(tǒng)中獸藥復(fù)方制劑,;
2.現(xiàn)代中獸藥復(fù)方制劑,包括以中藥為主的中西獸藥復(fù)方制劑,;
3.獸用天然藥物復(fù)方制劑,;
4.由中藥、天然藥物制成的注射劑,。
第四類 改變國內(nèi)已上市銷售產(chǎn)品的制劑,。
1.改變劑型的制劑;
2.改變工藝的制劑,。
(二)說明
1.第一類1是指獸藥國家標(biāo)準(zhǔn)中未收載的從中藥,、天然藥物中得到的未經(jīng)過化學(xué)修飾的單一成份及其制劑。
2.第一類2是指未被獸藥國家標(biāo)準(zhǔn)收載的中藥材及天然藥物制成的獸用制劑,。
3.第一類3是指用來代替中藥材某些功能的藥用物質(zhì),,包括:
(1)已被獸藥國家標(biāo)準(zhǔn)收載的中藥材;
(2)未被獸藥國家標(biāo)準(zhǔn)收載的藥用物質(zhì),。
4.第二類1是指具有獸藥國家標(biāo)準(zhǔn)的中藥材原動,、植物新的藥用部位制成的制劑,。
5.第二類2是指從中藥、天然藥物中提取的一類或數(shù)類成份制成的制劑,。
6.第三類1傳統(tǒng)中獸藥復(fù)方制劑是指中獸醫(yī)理論下組方,,功能主治用傳統(tǒng)的中醫(yī)理論表述,,傳統(tǒng)工藝制成的復(fù)方制劑,。
7.第三類2現(xiàn)代中獸藥復(fù)方制劑是指中獸醫(yī)理論下組方,包括中獸醫(yī)理論下使用非傳統(tǒng)藥材,,功能主治與中獸醫(yī)理論相關(guān),,工藝不做要求,。
8.第三類3獸用天然藥物復(fù)方制劑傳統(tǒng)中獸藥復(fù)方制劑是指不按中獸醫(yī)理論組方制成的制劑。
9.第三類4包括水針,、粉針之間的相互改變及其他劑型改成的注射劑
10.第四類1是指在給藥途徑不變的情況下改變劑型的制劑,。
11.第四類2包括:
(1)工藝有質(zhì)的改變的制劑;
(2)工藝無質(zhì)的改變的制劑,。
工藝有質(zhì)的改變主要是指在生產(chǎn)過程中改變提取溶媒,、純化工藝或其他制備工藝條件等,使提取物的成份發(fā)生較大變化,。
二,、注冊資料項(xiàng)目
(一)綜述資料
1.獸藥名稱。
2.證明性文件,。
3.立題目的與依據(jù),。
4.對主要研究結(jié)果的總結(jié)及評價。
5.獸藥說明書樣稿,、起草說明及最新參考文獻(xiàn),。
6.包裝、標(biāo)簽設(shè)計樣稿,。
(二)藥學(xué)研究資料
7.藥學(xué)研究資料綜述,。
8.藥材來源及鑒定依據(jù)。
9.藥材生態(tài)環(huán)境,、生長特征,、形態(tài)描述,、栽培或培植(培育)技術(shù),、產(chǎn)地加工和炮制方法等。
10.藥材性狀,、組織特征,、理化鑒別等研究資料(方法、數(shù)據(jù),、圖片和結(jié)論)及文獻(xiàn)資料,。
11.提供植,、礦物標(biāo)本,植物標(biāo)本應(yīng)當(dāng)包括花,、果實(shí),、種子等。
12.生產(chǎn)工藝的研究資料及文獻(xiàn)資料,,輔料來源及質(zhì)量標(biāo)準(zhǔn),。
13.確證化學(xué)結(jié)構(gòu)或組分的試驗(yàn)資料及文獻(xiàn)資料。
14.質(zhì)量研究工作的試驗(yàn)資料及文獻(xiàn)資料,。
15.獸藥質(zhì)量標(biāo)準(zhǔn)草案及起草說明,,并提供獸藥標(biāo)準(zhǔn)物質(zhì)的有關(guān)資料。
16.樣品及檢驗(yàn)報告書,。
17.藥物穩(wěn)定性研究的試驗(yàn)資料及文獻(xiàn)資料,。
18.直接接觸獸藥的包裝材料和容器的選擇依據(jù)及質(zhì)量標(biāo)準(zhǔn)。
(三)藥理毒理研究資料
19.藥理毒理研究資料綜述,。
20.主要藥效學(xué)試驗(yàn)資料及文獻(xiàn)資料,。
21.安全藥理研究的試驗(yàn)資料及文獻(xiàn)資料。
22.急性毒性試驗(yàn)資料及文獻(xiàn)資料,。
23.長期毒性試驗(yàn)資料及文獻(xiàn)資料,。
24.致突變試驗(yàn)資料及文獻(xiàn)資料。
25.生殖毒性試驗(yàn)資料及文獻(xiàn)資料,。
26.致癌試驗(yàn)資料及文獻(xiàn)資料,。
27.過敏性(局部、全身和光敏毒性),、溶血性和局部(血管,、皮膚、粘膜,、肌肉等)刺激性等主要與局部,、全身給藥相關(guān)的特殊安全性試驗(yàn)資料和文獻(xiàn)資料。
(四)臨床研究資料
28.臨床研究資料綜述,。
29.臨床研究計劃與研究方案,。
30.臨床研究及試驗(yàn)報告。
31.靶動物藥代動力學(xué)和殘留試驗(yàn)資料及文獻(xiàn)資料,。
三,、注冊資料項(xiàng)目說明
1.資料項(xiàng)目1獸藥名稱包括:獸藥的中文名、漢語拼音,、英文名,、及命名依據(jù)。
2.資料項(xiàng)目2證明性文件包括:
(1)申請人合法登記證明文件、《獸藥生產(chǎn)許可證》,、《獸藥GMP證書》復(fù)印件,。申請新獸藥注冊時應(yīng)當(dāng)提供樣品制備車間的《獸藥GMP證書》復(fù)印件;
(2)申請的獸藥或者使用的處方,、工藝等專利情況及其權(quán)屬狀態(tài)情況說明,,以及對他人的已有專利不構(gòu)成侵權(quán)的保證書;
(3)獸用麻醉藥品,、精神藥品,、毒性藥品研制立項(xiàng)批復(fù)文件復(fù)印件;
(4)直接接觸獸藥的包裝材料(或容器)應(yīng)符合藥用包裝材料的有關(guān)規(guī)定,。
如為進(jìn)口申請,,還應(yīng)提供:
(1)生產(chǎn)國家(地區(qū))獸藥管理機(jī)構(gòu)出具的允許申請的該獸藥上市銷售及該獸藥生產(chǎn)企業(yè)符合獸藥生產(chǎn)質(zhì)量管理規(guī)范的證明文件、公證文書,;出口國物種主管當(dāng)局同意出口的證明,;
(2)由境外生產(chǎn)企業(yè)常駐中國代表機(jī)構(gòu)辦理注冊事務(wù)的,應(yīng)當(dāng)提供《外國企業(yè)常駐中國代表機(jī)構(gòu)登記證》復(fù)印件,;
境外生產(chǎn)企業(yè)委托中國代理機(jī)構(gòu)代理申報的,,應(yīng)當(dāng)提供委托文書、公證文書以及中國代理機(jī)構(gòu)的《營業(yè)執(zhí)照》復(fù)印件,;
(3)安全性試驗(yàn)資料應(yīng)當(dāng)提供相應(yīng)的藥物非臨床研究質(zhì)量管理規(guī)范(GLP)證明文件,;臨床及其他試驗(yàn)用樣品應(yīng)當(dāng)提供相應(yīng)的藥品或獸藥生產(chǎn)質(zhì)量管理規(guī)范(GMP)證明文件。
3.資料項(xiàng)目3立題目的與依據(jù):中藥材,、天然藥物應(yīng)當(dāng)提供有關(guān)古,、現(xiàn)代文獻(xiàn)資料綜述。
中獸藥,、天然藥物制劑應(yīng)當(dāng)提供處方來源和選題依據(jù),,有關(guān)傳統(tǒng)中獸醫(yī)或中醫(yī)理論、古籍文獻(xiàn)資料,、國內(nèi)外研究現(xiàn)狀或生產(chǎn),、使用情況的綜述,以及對該品種創(chuàng)新性,、可行性等的分析,,包括和已有獸藥國家標(biāo)準(zhǔn)的同類品種的比較(具體要求另行制定)。
4.資料項(xiàng)目4對研究結(jié)果的總結(jié)及評價:包括申請人對主要研究結(jié)果進(jìn)行的總結(jié),,及從安全性,、有效性、質(zhì)量可控性等方面對所申報品種進(jìn)行的綜合評價,。
5.資料項(xiàng)目5獸藥說明書樣稿,、起草說明及最新參考文獻(xiàn):包括按有關(guān)規(guī)定起草的獸藥說明書樣稿,、說明書各項(xiàng)內(nèi)容的起草說明,、有關(guān)安全性和有效性等方面的最新文獻(xiàn),。
6.資料項(xiàng)目16樣品的檢驗(yàn)報告是指對申報樣品的自檢報告。報送資料時應(yīng)提供連續(xù)3批樣品的自檢報告及樣品,。
7.進(jìn)口申請?zhí)峁┑纳a(chǎn)國家(地區(qū))政府證明文件及全部技術(shù)資料應(yīng)當(dāng)是中文本并附原文,;其中質(zhì)量標(biāo)準(zhǔn)的中文本必須按《中國獸藥典》標(biāo)準(zhǔn)規(guī)定的格式整理報送。
8.由于新獸藥品種的多樣性和復(fù)雜性,,在申報時,,應(yīng)當(dāng)結(jié)合具體品種的特點(diǎn)進(jìn)行必要的相應(yīng)研究。如果申請減免試驗(yàn),,應(yīng)當(dāng)充分說明理由,。
四、注冊資料項(xiàng)目表及說明
(一)中獸藥,、天然藥物注冊資料項(xiàng)目表
(二)說明 1.申請新獸藥注冊,,按照《注冊資料項(xiàng)目 表》的要求報送資料項(xiàng)目1~31的資料。 2.中藥材的代用品如果未被獸藥國家標(biāo)準(zhǔn)收載,,除按注冊分類第一類2的要求提供申報資料外,,還應(yīng)當(dāng)與被替代藥材進(jìn)行藥效、毒理的對比試驗(yàn),,并通過相關(guān)制劑進(jìn)行臨床等效性研究,;中藥材的代用品如果已被獸藥國家標(biāo)準(zhǔn)收載,應(yīng)當(dāng)通過相關(guān)制劑進(jìn)行臨床等效性研究,。中藥材的代用品獲得批準(zhǔn)后,,申請使用該代用品的制劑應(yīng)當(dāng)按補(bǔ)充申請辦理,但應(yīng)嚴(yán)格限定在被批準(zhǔn)的可替代的功能范圍內(nèi),。如果代用品為單一成份,,應(yīng)當(dāng)提供動物藥代動力學(xué)試驗(yàn)資料及文獻(xiàn)資料,用于食品動物時應(yīng)當(dāng)提供殘留試驗(yàn)資料,,并制定休藥期,。 3.未在國內(nèi)上市銷售的中藥、天然藥物中提取的有效成份及制劑,,其單一成份的含量應(yīng)當(dāng)占總提取物的90%以上,,固體制劑同時還需提供溶出度的試驗(yàn)資料。 4.未在國內(nèi)上市銷售的中藥,、天然藥物中提取的有效部位制成的制劑,,其有效部位的含量應(yīng)占總提取物的50%以上。有效部位的制劑除按要求提供申報資料外,,尚需提供以下資料: (1)申報資料項(xiàng)目第12項(xiàng)中需提供有效部位篩選的研究資料或文獻(xiàn)資料,;申報資料項(xiàng)目第13項(xiàng)中需提供有效部位主要化學(xué)成份研究資料及文獻(xiàn)資料(包括與含量測定有關(guān)的對照品的相關(guān)資料); (2)由數(shù)類成份組成的有效部位,應(yīng)當(dāng)測定每類成份的含量,,并對每類成份中的代表成份進(jìn)行含量測定且規(guī)定下限(對有毒性的成份增加上限控制),。 申請由同類成份組成的有效部位制成的制劑,如其中含有已上市銷售的從中藥,、天然藥物中提取的有效成份,,且功能主治相同,則應(yīng)當(dāng)與該有效成份進(jìn)行藥效學(xué)及其他方面的比較,,以證明其優(yōu)勢和特點(diǎn),。 5.傳統(tǒng)中獸藥復(fù)方制劑,處方中藥材必須具有獸藥國家標(biāo)準(zhǔn),,并且該制劑的主治病證在國家中成藥標(biāo)準(zhǔn)中沒有收載,,可免做藥效、毒理研究,。但是,,如果有下列情況之一者需要做毒理試驗(yàn):①含有獸藥國家標(biāo)準(zhǔn)中標(biāo)示有毒性(劇毒或有毒)及現(xiàn)代毒理學(xué)證明有毒性的藥材;②含有十八反,、十九畏的配伍禁忌,。 6.現(xiàn)代中獸藥復(fù)方制劑,處方中使用的藥用物質(zhì)應(yīng)當(dāng)具有獸藥國家標(biāo)準(zhǔn),,如果處方中含有無獸藥國家標(biāo)準(zhǔn)的藥用物質(zhì),,應(yīng)當(dāng)參照注冊分類中第一類2的要求提供臨床前的相應(yīng)申報資料;如果處方中含有天然藥物,、有效成份或化學(xué)藥品,,則應(yīng)當(dāng)對上述藥用物質(zhì)在藥理、毒理方面的相互作用(增效,、減毒或互補(bǔ)作用)進(jìn)行相應(yīng)的研究,;如處方中含有化學(xué)藥品并用于食品動物時應(yīng)當(dāng)提供殘留試驗(yàn)資料,并制定休藥期,。 7.獸用天然藥物復(fù)方制劑應(yīng)當(dāng)提供多組分藥效,、毒理相互影響的試驗(yàn)資料及文獻(xiàn)資料,處方中如果含有無獸藥國家標(biāo)準(zhǔn)的藥用物質(zhì),,還應(yīng)當(dāng)參照注冊分類中第一類2的要求提供臨床前的相應(yīng)申報資料,。 8.進(jìn)口中獸藥、天然藥物制劑按注冊分類中的相應(yīng)要求提供申報資料,。 9.局部用藥的制劑尚須報送局部用藥毒性研究的試驗(yàn)資料及文獻(xiàn)資料,。10.中獸藥、天然藥物注射劑的主要成份應(yīng)當(dāng)基本清楚,。鑒于對中獸藥,、天然藥物注射劑安全性和質(zhì)量控制復(fù)雜性的考慮,,對其技術(shù)要求另行制定。 11.改變劑型應(yīng)當(dāng)說明新制劑的優(yōu)勢和特點(diǎn),。新制劑的適應(yīng)癥原則上應(yīng)當(dāng)同原制劑,。其中某些適應(yīng)癥療效不明顯或無法通過藥效或臨床試驗(yàn)證實(shí)的,應(yīng)當(dāng)提供相應(yīng)的研究資料,。 改變劑型或改變生產(chǎn)工藝時,,如果生產(chǎn)工藝有質(zhì)的改變,,申報資料應(yīng)當(dāng)提供新制劑與原制劑在制備工藝,、劑型、質(zhì)量標(biāo)準(zhǔn),、穩(wěn)定性,、藥效學(xué)、臨床等方面的對比試驗(yàn)及毒理學(xué)的研究資料,。 改變劑型或改變生產(chǎn)工藝時,,如果生產(chǎn)工藝無質(zhì)的改變,可減免藥理,、毒理和臨床的申報資料,。 改變工藝的制劑,僅限于有該品種批準(zhǔn)文號的生產(chǎn)企業(yè)申報,,其中工藝無質(zhì)的改變,,按照補(bǔ)充申請辦理。 12.按新獸藥申請的藥物應(yīng)當(dāng)按照獸藥臨床試驗(yàn)指導(dǎo)原則的要求進(jìn)行臨床試驗(yàn),。 13.中藥材代用品的功能替代研究應(yīng)當(dāng)從獸藥國家標(biāo)準(zhǔn)中選取能夠充分反映被代用藥材功效特征的中獸藥制劑作為對照藥進(jìn)行比較研究,,每個功效或適應(yīng)癥需經(jīng)過兩種以上中藥制劑進(jìn)行驗(yàn)證。 14.改變給藥途徑,、改變劑型或者工藝有質(zhì)的改變的制劑,。 (1)應(yīng)當(dāng)根據(jù)獸藥的特點(diǎn),設(shè)計不同目的的臨床試驗(yàn),; (2)進(jìn)行生物等效性試驗(yàn)的獸藥,,可以免臨床試驗(yàn); (3)緩釋,、控釋制劑,,應(yīng)當(dāng)進(jìn)行動物藥代動力學(xué)研究和臨床試驗(yàn)。臨床前研究工作應(yīng)當(dāng)包括緩釋,、控釋制劑與其普通制劑在藥學(xué)和生物學(xué)方面的比較研究,,以提示此類制劑特殊釋放的特點(diǎn)。 來源:獸藥資訊,。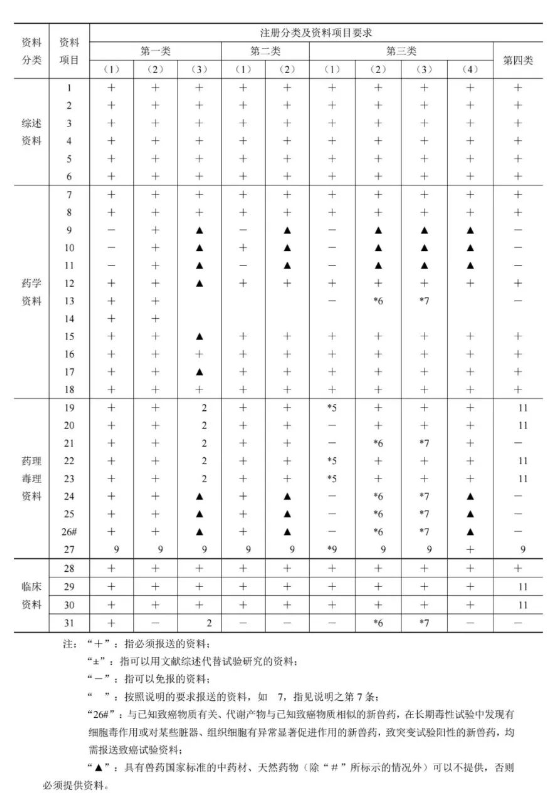
國家獸藥產(chǎn)業(yè)技術(shù)創(chuàng)新聯(lián)盟 National veterinary drug industry technology innovation alliance |
掃一掃  |
| 聯(lián)系電話:010-62103991轉(zhuǎn)611 聯(lián)系地址:北京市海淀區(qū)中關(guān)村南大街8號 備案:京ICP備20024024號 |